Lo stato termodinamico dell'aria è misurato mediante la sua pressione, densità e temperatura. In questo articolo tratteremo separatamente i tre parametri appena menzionati cercando di spiegare nel dettaglio il significato e il ruolo che ciascuno di essi ha nello studio dell'atmosfera.
Iniziamo pertanto con il concetto di:
PRESSIONE
 La pressione P è il rapporto fra la forza F agente perpendicolarmente ad una superficie e l'area A di tale superficie:
La pressione P è il rapporto fra la forza F agente perpendicolarmente ad una superficie e l'area A di tale superficie:
1 Pa = 1 N/m2
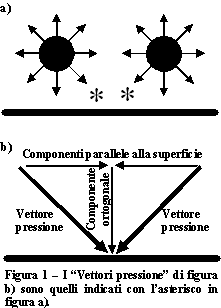
In un fluido qual è quello atmosferico la pressione è di tipo isotropico; ciò significa che in ogni punto la pressione agisce con la stessa forza in tutte le direzioni. Tuttavia, rispetto ad una superficie solida immersa nel fluido, la pressione è data solo dalle componenti perpendicolari alla superficie stessa, in quanto le componenti parallele si cancellano fra loro (figura 1).
Tale considerazione non è priva di conseguenze! Proviamo a fare un esempio numerico. Consideriamo il tubo catodico di un apparecchio TV o di un tipico monitor CRT per computer avente una superficie di area A = 0.186 m2 (cioè con una diagonale dello schermo d = 61 cm). Come è noto nel tubo catodico viene fatto il vuoto. Al livello del mare la pressione che preme perpendicolarmente sul vetro del monitor (qualunque sia la sua posizione) sarà pari a quella atmosferica (101.325 kPa, per esempio) non essendoci alcun altra pressione a controbilanciarla (nel tubo catodico infatti c'è il vuoto!). Ci chiediamo allora: che forza viene esercitata sul vetro?
Tale forza F sarà pari a F = Fout - Fin = Fout = P · A = 101325 N/m2 · 0.186 m2 = 18.85 kN, una forza enorme! Per rendersene conto basta considerare che un uomo del peso di 68 kg "preme" sul suolo, per effetto della forza di gravità, con una forza di circa 667 N (0.667 kN). In poche parole, il vetro del nostro schermo dev'essere capace di sopportare l'equivalente della pressione di 28 persone in piedi su di esso! Per questo il vetro usato per costruire TV e monitor CRT ha un notevole spessore.
Ma torniamo all'atmosfera. La pressione atmosferica che si misura ad una certa altezza è dovuta al peso delle molecole d'aria sovrastanti; poiché più si sale in altitudine e minore sarà il numero di molecole al di sopra, la pressione diminuisce all'aumentare della quota ed aumenta viceversa.
Abbiamo detto che il valore medio della pressione atmosferica al livello del mare è pari a 1013.25 hPa, cioè questa è la pressione media al livello del mare esercitata dal peso di tutta la colonna d'aria sovrastante. Questa pressione equivale a quella che esercita una colonna di mercurio (Hg) alta 760 mm oppure una colonna d'acqua (H2O) alta 10.33227 m.
Ma una maggiore pressione significa anche una maggiore densità (cioè più molecole si troveranno in un determinato volume) e naturalmente ciò sarà tanto più vero quanto più ci abbassiamo di quota. Inoltre, come risultato della presenza di più molecole ravvicinate in un piccolo spazio nei pressi degli strati inferiori dell'atmosfera piuttosto che in quelli superiori, la pressione atmosferica decresce più velocemente, con la quota, nei pressi del suolo piuttosto che più in alto, a parità di intervallo di quota percorsa. Al di sotto dei 105 km circa l'andamento della pressione atmosferica P con l'altezza z è di tipo esponenziale. Per esempio, nell'ipotesi che la temperatura vari uniformemente con l'altezza (cosa che in realtà non è) si ha:
dove a = 0.0342 K/m (ricordiamo che nel S.I. la temperatura si misura in gradi Kelvin (K); per la conversione in gradi centigradi (°C) basta considerare che °C = °K - 273.15) e dove P0 = 101.325 kPa è la pressione atmosferica media sul livello del mare, come sappiamo. Si tratta di un'approssimazione molto buona tenuto conto che, anche considerando l'andamento reale della temperatura con la quota, la curva reale differisce molto poco da quella esponenziale.
L'equazione appena vista può essere anche scritta nella forma:
dove Hp = 7.29 km rappresenta la velocità con cui decresce la curva della pressione di atmosferica all'aumentare di z.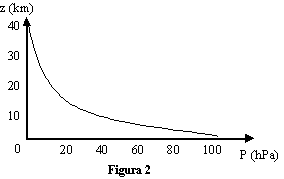
In figura 2 è riportato un grafico approssimativo della curva esponenziale con z sull'asse delle ordinate e P sull'asse delle ascisse nel caso di T = 280 K. Da un'analisi più approfondita si può scoprire che nei primi 3 km di atmosfera la pressione decresce abbastanza linearmente di circa 10 kPa per ogni km di altitudine (cioè di 1 mb ogni 10 metri).
Grazie al fatto che la pressione atmosferica possiede questo andamento "tipico" e noto con l'altezza, si sfrutta tale conoscenza per avere una stima dell'altezza a cui ci si trova (gli altimetri tradizionali altro non sono infatti che barometri su cui è riportata la scala delle altezze, oltre a quella della pressione).
Osservando la formula che descrive l'andamento della pressione atmosferica con la quota, abbiamo notato che la rapidità con cui varia tale pressione dipende dalla temperatura. Ciò porta ad una conseguenza importantissima:
la pressione atmosferica cresce più lentamente con l'altezza nell'aria calda rispetto a quella fredda
Questo perché nell'aria calda le molecole sono maggiormente distanziate fra loro e quindi salendo di quota ci si "libera" di meno "zavorra".
DENSITA'
A livello del mare, a 15°C di temperatura (T = 288.15 K), la densità dell'atmosfera è pari a ρ0 = 0.001225 g/cm3 = 1.225 kg/m3. Sembra un valore molto piccolo, eppure se ci domandiamo quanto pesa al livello del mare una massa d'aria contenuta in una stanza di dimensioni 5m · 8m · 2.5m otteniamo m = ρ · V = (1.225 kg/m3 · 100 m3) = 122.5 kg!
Non solo: in alta quota l'aria è estremamente rarefatta eppure può ancora produrre importanti fenomeni come la luce crepuscolare fino a 63 km di altezza (dovuta alla diffusione (scattering) della luce solare che viene riflessa dalle molecole d'aria), le meteore (incandescenza per surriscaldamento delle meteoriti causato dall'attrito con l'aria) tra i 110 e i 200 km, e le aurore (dovute all'eccitazione delle molecole dell'atmosfera per mezzo del vento solare) tra i 360 e i 500 km.
Se applichiamo la formula che fornisce la densità, scopriamo ad esempio che a 2000 metri di quota, supponendo una temperatura costante di 15°C, la densità dell'aria scende a 0.928 kg/m3, cioè il 24% in meno. Ciò significa che un aereoplano avrà il 24% in meno di portanza e i suoi motori potranno produrre una spinta ridotta del 24%.
TEMPERATURA
Quando in un gruppo di molecole microscopiche esse si muovono prevalentemente nella stessa direzione di moto, tale movimento è chiamato vento. Quando invece le particelle si muovono in tutte le direzioni in modo casuale (come in un moto "agitato") allora il moto è in questo caso associato al concetto di temperatura. Valori più alti di temperatura T sono associati a valori più alti della velocità media v delle particelle secondo la relazione:
Proviamo ad eseguire un piccolo calcolo chiedendoci qual è la velocità media associata all'agitazione termica dell'azoto a 20°C
Ebbene, T = 20°C = 273.15 + 20 = 293.15 K; quindi v = T / (a · mw) = 511.5 m/s (con mw = 28.01, vedi tabella 1). A 20°C dunque la velocità media delle molecole di azoto è maggiore della velocità di una pallottola!
Ricordiamo che in tutte le leggi fisiche l'unità di misura della temperatura da usare è quella che esprime quest'ultima in Kelvin. Tuttavia per comodità riportiamo anche le principali formule per convertire la temperatura da un unità di misura all'altra:
Ad esempio la temperatura media dell'atmosfera di tutto il pianeta a livello del mare è pari a 15°C = 288 K = 59°F. Per quanto riguarda la variazione della temperatura con la quota possiamo dire che tale andamento non è di tipo semplice come nel caso appena visto della pressione e della densità atmosferica, pertanto dev'essere oggetto di discussione a parte.
| Tabella 1 | |||
| Simbolo | Nome | Peso Molecolare (g/mole) | Frazione volume bassa atmosfera (%) |
| Gas costanti | |||
| N2 | Azoto | 28.01 | 78.08 |
| O2 | Ossigeno | 32.00 | 20.95 |
| Ar | Argo | 39.95 | 0.93 |
| Ne | Neon | 20.18 | 0.0018 |
| He | Elio | 4.00 | 0.0005 |
| H2 | Idrogeno | 2.02 | 0.00005 |
| Xe | Xenon | 131.30 | 0.000009 |
| Gas variabili | |||
| H2O | Vapore acqueo | 18.02 | 0 ÷ 4 |
| CO2 | Biossido di Carbonio | 44.01 | 0.035 |
| CH4 | Metano | 16.04 | 0.00017 |
| N2O | Ossido di Azoto | 44.01 | 0.00003 |
| CO | Monossido di Carbonio | 28.01 | 0.0035 |
| SO2 | Biossido di Zolfo | 64.06 | 0.000014 |
| O3 | Ozono | 48.00 | 0.000012 |
| NO2 | Biossido di Azoto | 46.01 | 0.000005 |
| Condizioni medie dell'aria | |||
| Aria | 28.96 | 100.0 | |
Approfondimenti - La funzione esponenziale
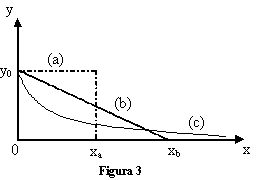
Esistono alcune curve che non finiscono mai. Osserviamo la figura 3: la curva (a) finisce in corrispondenza di x = xa, mentre la curva (b) termina per x = xb. Invece la curva (c) rappresenta una funzione esponenziale decrescente: essa, partendo dal valore iniziale y0, tende a 0 solo asintoticamente, senza cioè mai raggiungere l'asse delle ascisse. L'area sottesa da tutte e tre le curve è finita ed ha lo stesso valore. Sebbene la curva esponenziale non finisca mai è possibile però quantificare quanto rapidamente essa decresce.
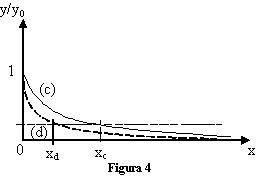
A tale scopo si definisce il valore di x rispetto al quale la curva si riduce di 1/e rispetto al valore di partenza della variabile dipendente (ricordiamo che e = 2.71828 è la base dei logaritmi naturali): tale valore di x viene chiamato "e-folding distance" (o e-folding time, nel caso la variabile indipendente sia un tempo t) e la indicheremo genericamente come xe-fold.
Nell'esempio di figura 4, entrambe le curve (c) e (d) sono esponenziali, ma tendono a 0 a una velocità diversa, come si può verificare osservando le diverse distanze xc e xd. Un'altra caratteristica utile è sapere e l'area A sottesa da una curva esponenziale è pari a A = y0 · xe-fold.
Approfondimenti - Velocità di fuga e temperatura
Se una molecola d'aria si muove abbastanza velocemente e non urta altre molecole essa può fuggire verso lo spazio per mezzo dello scambio tra la sua energia cinetica (che dipende dalla velocità) e la sua energia potenziale gravitazionale (dipendente dalla quota della particella). Nell'alta atmosfera, dove l'aria è molto più rarefatta, le molecole hanno le maggiori possibilità di non incontrarne altre. Ciò fa sì che esse possano raggiungere più facilmente quote più alte ed avvicinarsi allo spazio esterno. La quota più bassa alla quale questo può accadere sulla Terra è circa 550 km, la quota che definisce l'inizio dell'esosfera (la regione dei gas che possono fuggire). Questa stessa altitudine, se misurata a partire dal centro della Terra, è pari a circa 6920 km ed è chiamata raggio critico rc. La velocità di fuga ve è data da:
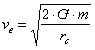
dove G = 6.67 · 10-11 m3 s-2 kg-1 è la costante gravitazionale, m è la massa del pianeta (la massa della Terra è di 5.975 · 1024 kg). Quindi sulla Terra la velocità di fuga è ve = 10.732 m/s.
Ricordando il legame fra velocità e temperatura noi possiamo determinare la temperatura necessaria affinché una particella possa avere una velocità media sufficiente per sfuggire all'attrazione gravitazionale terrestre. Ad esempio, l'idrogeno ha bisogno di una temperatura di 9.222 K, mentre l'elio necessita di una temperatura superiore (18.445 K) in quanto è più pesante.
Nell'esosfera (conosciuta anche come termosfera) la temperatura non è sufficientemente elevata da permettere all'idrogeno e all'elio di fuggire completamente, tuttavia molte molecole hanno una velocità maggiore di quella media e possono quindi farcela. Altre molecole come l'ossigeno, invece, sono talmente pesanti che avrebbero bisogno di una temperatura di 147.562 K per scappare via e ciò, fortunatamente per noi, non è ottenibile (quindi praticamente tutto l'ossigeno rimane "ancorato" al nostro pianeta).
Considerazioni conclusive: le tre variabili viste di pressione, densità e temperatura sono tra le più importanti per descrivere e modellare l'atmosfera. Assieme alle tre componenti del vento (due sul piano orizzontale, una su quello verticale) rappresentano le incognite base utilizzate nelle equazioni dei modelli fisico-matematici.
